一、酸碱指示剂
遇到酸或碱的溶液,本身可显示不同颜色的物质。常见的指示剂有石蕊、酚酞等。
二、常见的酸
常见的酸:盐酸(HCl)、硫酸(H2SO4)、硝酸(HNO3)、醋酸(CH3COOH)
1、盐酸、硫酸的性质
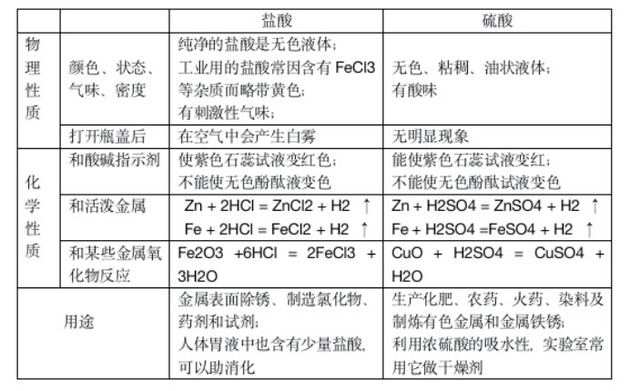
2、浓盐酸、浓硫酸的特性
浓盐酸:
易挥发:打开瓶盖,会看到白雾(注意不是白烟),这是由于浓盐酸会发出的氯化氢气体与空气中的水蒸气结合形成的盐酸小液滴;
长时间敞口放置浓盐酸,质量会减少,质量分数减小,发生物理变化;
浓硫酸:
①脱水性:它能夺取纸张、木材、皮肤(都由碳、氢、氧等元素的化合物组成)里的水分,生成黑色的炭,所以它具有强烈的腐蚀性,如不慎沾到皮肤或衣服上,应立即用大量水冲洗,然后涂上3%~5%的碳酸氢钠溶液;
②吸水性:可做干燥剂。如果长期露置在空气中,会吸收空气中的水蒸气,使硫酸的溶质质量分数变小。浓硫酸可干燥不和它反应的气体,如O2、H2、CO2等,但不能干燥和它反应的NH3。
③强氧化性:
④酸性:
⑤浓硫酸的稀释:一定要把浓硫酸沿器壁慢慢注入水里,并不断搅拌。切不可将水倒入浓硫酸中。否则由于水的密度小,浮在浓硫酸上面,溶解时放出的热量不易散失,使水暴沸,带着酸液四处飞溅。
三、常见的碱
常见的碱:氢氧化钠NaOH、氢氧化钙Ca(OH)2、氢氧化钾KOH、氨水NH3·H2O。
1、氢氧化钠、氢氧化钙的性质

2、氢氧化钠易潮这一性质,可做干燥剂。
3、熟石灰:可由生石灰与水反应而制得:
CaO+H2O=Ca(OH)2(放热)
四、中和反应
中和反应:酸跟碱生成盐和水的反应。
例如:HCl+NaOH=NaCl+H2O
Ca(OH)2+2HCl=CaCl2+2H2O
Al(OH)3+3HCl=AlCl3+3H2O
应用:
①改变土壤的酸碱性:用熟石灰改良酸性土壤;
②处理工厂的废水:硫酸厂的污水可用熟石灰中和处理;
③用于医药:用Al(OH)3中和过多的胃酸;蚊子叮咬后涂一些NH3·H2O、牙膏或肥皂水等碱性物质;被黄蜂刺了(黄蜂的刺是碱性的)就可以用食醋涂在皮肤上。
五、盐
由金属阳离子(或氨根离子)和酸根离子组成的化合物叫做盐。例如,NaCl、KNO3、NaSO4、NaHCO3等.
盐+金属:Cu+2AgNO3=Cu(NO3)2+2Ag(置换反应)
条件:①参加反应的单质金属比盐中的金属活泼:
②参加反应的盐是可溶性盐;
盐+酸:CaCO3+2HCl=CaCl2+H2O+CO2↑(复分解反应)
条件:符合复分解反应发生的条件,且盐能溶于酸。
盐+碱:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH(复分解反应)
条件:符合复分解反应发生的条件,且盐、碱都能溶于水。
盐+盐:NaCl+AgNO3==AgCl↓+NaNO3。
条件:符合复分解反应发生的条件,且盐能溶于水。